- 所有服务
- 生命科学服务平台
- 诊断原料开发服务平台
- 抗体药物研发服务平台
同源建模服务系统
背景介绍
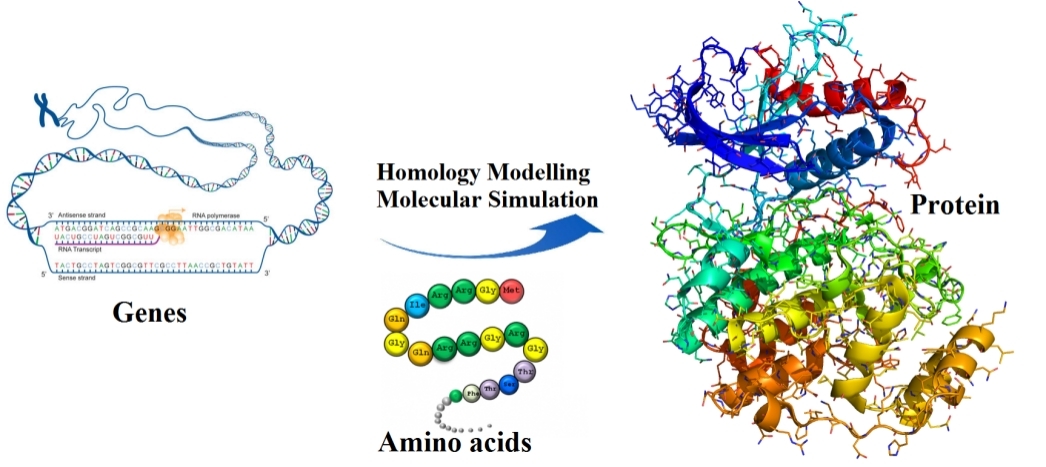
生物分子结构同源建模
同源模建,蛋白三维结构是理解其生物学功能和进行基于结构的药物设计的重要基础。随着结构生物学的快速发展,使用NMR或X-Ray晶体学等方法测量蛋白三维结构的速度得到了很大提高。然而,由于诸多原因,例如分子量过大或难于结晶,一些蛋白的三维结构仍然难以测定。这种场景下,必须借助计算模拟的手段,来构建蛋白的三维结构。在众多的计算机建模方法中,同源建模(Homology Modeling)是一种技术最为成熟、准确度最高、结果最为可靠的手段。同源建模(Homology Modeling)的基本假设是:如果未知结构蛋白A与已知结构蛋白B之间具有序列、结构和功能上的同源性,则蛋白A可以以蛋白B为模版来构建其全原子三维结构。
该部分主要包含对蛋白质和小分子结构的构建与优化。对于未知结构的蛋白质分子,在已知基因或氨基酸序列基础上,通过同源建模方法进行结构预测和同源构建。随后在建模蛋白质结构基础之上,利用动力学软件进行分子动力学模拟,以得到其最优结构模式。
| Modeller Easy Modeller Swift Modeller Discovery Studio Swiss Model I-TASSER HOMCOS … |
图1 蛋白质同源建模与相关软件 | |
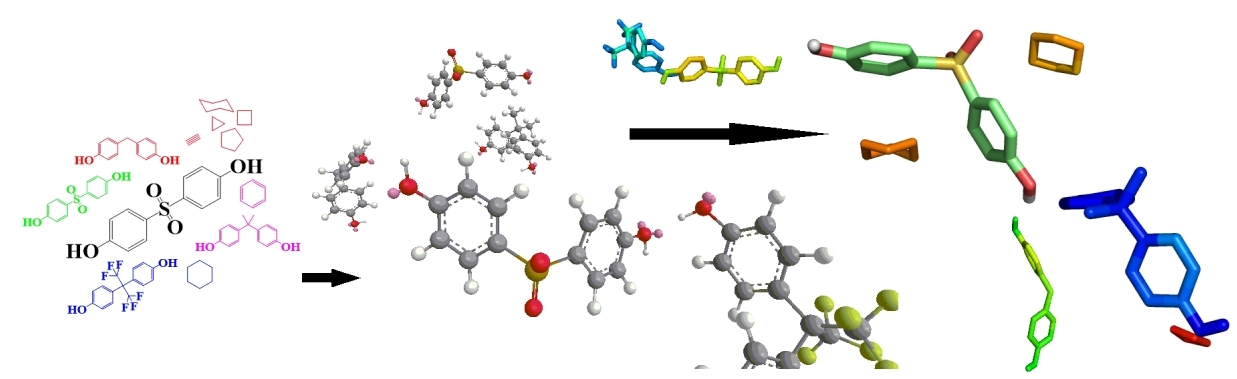
通过经典化学构图方法对小分子化合物进行结构构建,并采用量化软件(Gaussian,ORCA等)计算分子电荷分布、分子轨道和反应活化能等对其进行结构优化。
|
图2 小分子模型构建 |
构建同源模型的流程通常都是简洁而清晰的。首先,通过序列相似性搜索工具为查询序列(Query)搜索序列相似程度较高的已知结构蛋白作为候选模版。其次,将查询序列与候选模版进行比对对齐(Alignment),以序列相同度(Indentity)为指标,从中挑选一个或多个模版组合作为最终模版。自此进入建模的实际阶段:比对对齐后,那些与模版序列完全相同的残基所有原子座标完全拷贝自模版,而那些相似残基仅有骨架原子取自模版——侧链座标另行构建,那些缺失序列则通过查找一个Loop 数据库来进行补缺;最后,这个虚拟的预测模型在特定的势场参数下进行能量优化,得到最终模型。
研锦生物提供高质量的同源建模服务,其结果可以帮助研究人员了解目标蛋白的结构性质,分析其“结构—功能”关系,并可用于药物筛选、发现某种疾病的潜在治疗药物,或者研究靶标与药物的相互作用模式等。