哺乳动物细胞表达
哺乳动物细胞传代培养
随着细胞基因工程的不断发展,目前有多种生物表达系统都能够大规模的生产重组蛋白,主要分为原核和真核两类。 真核表达系统又包括:酵母表达系统,哺乳动物细胞表达系统,昆虫杆状病毒表达系统。相比之下,哺乳动物细胞表达系统最突出的优点是能够促进蛋白的正确折叠和糖基化等翻译后修饰,从而保证蛋白的天然活性,目前已成为表达和生产部分蛋白药物、基因工程抗体等目的蛋白的首选宿主。
哺乳动物蛋白表达常用的细胞有 HEK293(人胚肾细胞)和 CHO(中国仓鼠卵巢细胞)。这两种细胞的应用最为广泛,是在真核蛋白表达系统中最常用的细胞,具有以下特点:
1.具有准确的转录后修饰功能,表达蛋白在任何方面都最接近天然状态;
2.具有重组基因的高效扩增和表达能力,外源蛋白整合稳定;
3.具有较高的耐受剪切力和渗透压能力,表达水平较高;
4.CHO 属于成纤维细胞,是一种非分泌细胞,自身很少分泌内源蛋白,有利于目的蛋白的分离纯化;
5.HEK293 细胞具有更高的生长密度更快的生长速度,易培养,易转染。
本文主要对 HEK293 细胞及 CHO 细胞传代培养的基本原则、实验步骤及注意事项进行介绍。
细胞培养基本原则
合适的细胞培养基
合适的细胞培养基是细胞传代培养最重要的条件,培养基不仅提供给细胞在体外生长繁殖需要的基础物质,还维持 细胞生长的整个环境,不同的细胞有不同的生长习性,因此要选择合适的培养基。
优质血清
目前,多数的合成细胞培养基都有添加血清,常用的血清有小牛血清、马血清等。血清中含有细胞生长所必须的生 长因子,作为哺乳动物细胞培养的附加物,血清十分昂贵且存在多种问题,因此人们在不断寻找可以替代血清的物 质。
无毒无菌的生长环境
体外生长的细胞缺乏对微生物和有毒物质的抵御能力,一旦被污染,会导致细胞死亡。因此在进行细胞传代培养时, 无毒无菌的培养环境是必要条件。
温度与气体环境
细胞生长需要恒定的温度,同时气体(氧气与二氧化碳)也是哺乳动物细胞培养的所必须的物质,HEK293 和 CHO 的细胞培养条件一般是 37℃,5%的二氧化碳环境。
细胞传代实验流程
细胞复苏
1.提前将水浴锅打开,预热 37℃。
2.细胞培养基提前预热,5-10ml 于 15ml 离心管中。
3.把冻存细胞立即投入 37℃水浴锅中,轻微摇动,待融化后(大概 1-1.5min),取出。
4.用 75%乙醇消毒管外壁,放入超净台,转移到含 5-10ml 培养基的 15ml 离心管中,离心 800-1000rpm,5min。
5.去掉上清,加入完全培养基重悬细胞,转移到培养皿中,前后左右轻轻摇动,使培养皿中的细胞分散均匀。
6.标记好细胞名称,代数,日期,培养基等,放到 37℃的 5% CO2 培养箱中培养。
7.贴壁细胞培养一般第二天就可以贴壁,根据细胞生长速度,2-3 天换一次培养基。
8.离心可能对某些细胞造成伤害,这些细胞可以不离心,只需要将 DMSO 的浓度降到 1%以下即可。(一般冻存液中 DMSO 浓度为 10%,即 1ml 冻存细胞需加 9ml 培养基。)
细胞传代培养
1.当培养皿中的细胞覆盖率达到 80%-90%时需要进行细胞传代。
2.吸掉培养皿中的旧培养液。
3.用 5ml PBS 洗涤细胞 1-2 次。
4.用 1ml 的 trypsin(胰酶)溶液,37℃作用数分钟,于倒立显微镜下观察,当细胞呈圆形即将分离时,吸掉 trypsin 溶液。(若不去掉 trypsin 溶液,则在消化后加入适量(5:1)含血清培养基终止作用,离心后再去掉上清。)
5.轻拍培养皿或培养瓶使细胞从瓶壁脱落,加入适量的新鲜完全培养基,轻柔地吹打数次,使细胞分散均匀。再根据稀释比例转移至新的培养瓶中,正常培养即可,剩余细胞悬液舍弃,放入收集瓶中。(细胞传代时按 1:5 或更大比例稀释)
6.trypsin 溶液中可以加入 0.02% EDTA 溶液,解离效果会更好,但消化后残留在培养基中的 EDTA 会影响细胞的再次贴壁。
细胞冻存
1. 冷冻前确保细胞处于指数生长期,传代后的 5mL 细胞悬液取出 1mL 接种到培养瓶继续传代。另取一无菌离心管,将剩余 4mL 细胞悬液置于其中,离心 1000rpm,5min(转速勿超过 1500rpm)。
2. 离心后倒掉上层清液,收集下层细胞沉淀。向离心管中加入 900ul 完全培养基,用枪头反复吹打重悬起细胞。取少量细胞悬液计数细胞浓度及冻前存活率。一般细胞浓度为 2~5×106cells/mL 较适宜。
3. 将细胞悬液转入 1.5mL 无菌冻存管中,再加入 100ul 试剂级 DMSO,混匀,制成细胞冻存悬液(DMSO 最后浓度为 10%)。严密封口后,注明细胞名称、代数、日期,然后进行冻存。
4. 传统方法:冷存管置于 4℃ 10 分钟→-20℃ 30 分钟→-80℃ 16~18 小时(隔夜)→液氮罐长期储存(-20℃
勿超过 1 小时,防止胞内冰晶过大造成细胞死亡)。
细胞培养注意事项
细胞培养大瓶好于小瓶,细胞能够充分汲取到养分且有利于细胞均匀分布
细胞培养基 DEME 为高糖培养基
保证细胞培养液新鲜,采用少量多次配置,或培养基保存于-20℃
控制胰蛋白酶消化时间,消化时间长,细胞贴壁效果差
控制好细胞传代时间,细胞没有完全铺满、细胞之间留有空隙时传代最佳
细胞冻存和复苏的原则是慢冻快复,最大程度的保证细胞复苏成功率
研锦生物具有丰富的细胞培养经验,熟悉各类细胞的培养方法:
名称 | 中文名称 | 名称 | 中文名称 |
293T | 人胚肾细胞 | M14 | 人黑色素瘤细胞 |
293F | 人胚肾细胞 | MB49 | 小鼠膀胱癌细胞 |
A375 | 人恶性黑色素瘤细胞 | MCF-7 | 人乳腺癌细胞 |
A431 | 人表皮癌细胞 | MCF-10A | 人乳腺癌细胞 |
A549 | 人非小细胞肺癌细胞 | MDA-MB-453 | 人乳腺癌细胞 |
AGS | 胃癌细胞 | MDCK | 狗肾细胞 |
BALB/3T3 | 小鼠胚胎成纤维细胞 | NCI-H1581 | 人大细胞肺癌细胞 |
BHK21 | 仓鼠肾成纤维细胞 | NCI-H226 | 人肺鳞癌细胞 |
BHT101 | 人甲状腺癌细胞 | NCI-H358 | 人非小细胞肺癌细胞 |
Caco-2 | 人结直肠腺癌细胞 | NHDF | 正常人皮肤成纤维细胞 |
CHO-K1 | 中国仓鼠卵巢细胞 | PC3 | 人前列腺癌细胞 |
COS-7 | 非洲绿猴SV40转化的肾细胞 | SK-CO-1 | 人结直肠腺癌细胞 |
HEK293 | 人胚肾细胞 | SK-LU-1 | 人低分化肺腺癌细胞 |
HCT-116 | 人结肠癌细胞 | SMMC-7721 | 人肝癌细胞 |
HeLa | 人宫颈癌细胞 | SW116 | 人结肠腺癌细胞 |
HepG2 | 人肝癌细胞 | SW620 | 人结肠腺癌细胞 |
HFF-1 | 人胚肺成纤维细胞 | THP-1 | 人外周血的单核细胞 |
HO8910PM | 人卵巢癌细胞 | U251 | 人胶质瘤细胞 |
HL-60 | 人原髓细胞白血病细胞 | U-87-MG | 人脑星形胶质母细胞瘤 |
LNCaP | 人前列腺癌细胞 | Vero | 非洲绿猴肾细胞 |
A427 | 人肺癌细胞 | MDA-MB-231 | 人乳腺癌细胞 |
AHH-1 | 人淋巴细胞 | p116 | 急性淋巴白血病细胞 |
BEL-7405 | 人肝癌细胞 | SK-MEL-5 | 人皮肤恶性黑色素瘤细胞 |
COV434 | 人卵巢颗粒肿瘤细胞 | SK-N-AS | 人神经母细胞 _ |
DU145 | 人前列腺癌细胞 | SNU-5 | 人胃癌细胞 |
HUVEC | 人脐静脉内皮细胞 | RH7777 | 大鼠肝癌细胞 |
H1703 | 人肺鳞癌细胞 | 开发中...... | |
瞬时转染与稳定转染实验原理的异同
瞬时转染与稳定转染都是将目的基因转染至特定哺乳动物细胞内,进而表达得到目的蛋白。不同的是瞬时转染的方式外源基因并没有转染到细胞的染色体上而是存在于游离的载体上,这样可以在短时间内获得基因的表达产物,但是随着细胞的不断分裂增殖外源基因最终会丢失,无法继续进行重组蛋白的生产;而利用细胞稳定转染则会将外源基因转染至细胞染色体上,目的基因不会随着细胞传代而消失,稳定转染的细胞株能够长期稳定的生产目的蛋白。
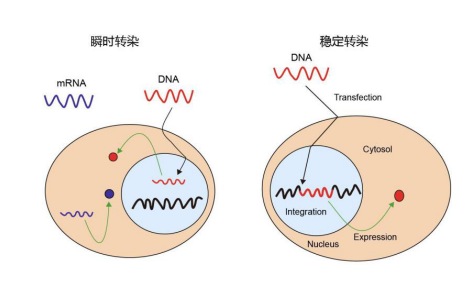
图 1:瞬时转染与稳定转染原理对比
实验操作的差别
1.瞬时转染与稳定转染所用的质粒是不同的,瞬转的质粒不需要带有抗性,而用于稳定转染的质粒一定要带有特定的抗性以便于后续的克隆株筛选。另外,两者所用的培养基及实验试剂也有所区别。
2.构建好质粒后,经过细胞复苏、转染、细胞培养、蛋白纯化等步骤即可得到目的蛋白;而构建稳定细胞系需要先将构建好的质粒线性化,再导入培养好的哺乳动物细胞内,通过一定的转染方式实现质粒与细胞的融合,接着经过细胞池筛选、单克隆筛选、细胞传代培养等步骤才能得到稳定转染的细胞系。对稳定细胞系进行培养能够长期稳定的生产目的蛋白。
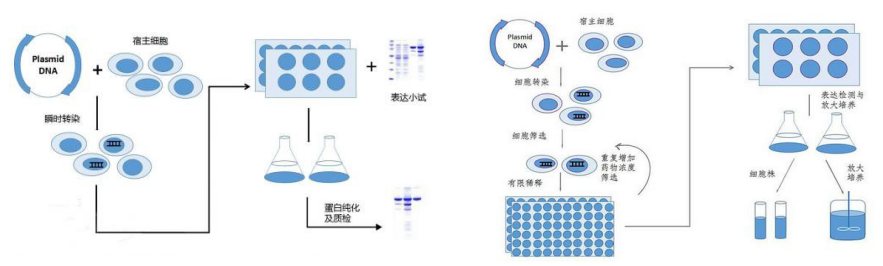
图 2:瞬时转染实验流程 图 3:细胞稳定转染实验流程
瞬时转染与稳定转染优缺点对比
瞬时转染 | 稳定细胞系构建 | |
优点 | 1. 能够快速生产得到微量至中量的重组蛋白 2.实验成本低 3.一个宿主可以带有多个拷贝,表达效率高 | 能够长期稳定生产目的蛋白 1.得到稳转株之后后续生产蛋白的成本大大降低 2.能够对基因进行基因插入、基因敲除等编辑操作 |

