技术快报---OpenSPR快速测定目标蛋白浓度

什么是浓度分析?
一般在浓度分析中,需加入不同浓度的目标分析物做测定,并根据测量的结果对每个样本的浓度创建一个标准曲线。随着分析物浓度的增加,与固定的结合配偶体的结合速率也增加。然后通过标准曲线确定未知的样品中分析物的浓度。
为什么我们要测量蛋白浓度?
蛋白对研究很重要,因为它们构成了植物和动物细胞功能的基础。而且,还需要蛋白浓度分析来确定蛋白的质量、数量以及生物反应的状态。此外,在通过色谱、电泳和免疫化学技术处理蛋白样品进行提取,分离和分析之前,确定蛋白浓度是必要的。在实验过程中,需要根据蛋白质量要求和你实验中所需蛋白纯度和蛋白量而选择不同的蛋白测定方法。选择合适的方法测定样本蛋白将影响到你研究的整体成功。因此蛋白浓度测定及方法的选择至关重要。
OpenSPR如果快速测定α-乳清蛋白浓度 ?
如何快速,简单且低成本的测定蛋白浓度呢?OpenSPR可以帮助你。接下来我们就来给大家展示如何用OpenSPR快速测定牛奶中的一个重要蛋白α-乳清蛋白的含量。α-乳清蛋白是存在于所有哺乳动物乳汁中的14kDa蛋白质,它是人乳中第二丰富的乳清蛋白;由于其高营养价值,经常被添加到婴儿配方奶粉中。因此,需要浓度测定,以确定婴儿配方食品中的补充含量,及牛奶中的天然含量和牛奶蛋白中的乳蛋白分离物的含量。
与ELISA等技术相比,SPR提供了一种简单,快速且经济的平台,因为它不需要标记,可以实时获得结果,并且相同的传感器表面可用于许多样品的检测即芯片可重复利用。因此我们开发了一种使用OpenSPR测量α-乳清蛋白浓度的方法。该测量法能够测量15ng/ml至1000ng/ml的蛋白浓度,具有极佳的重复性。该测定可在5分钟内提供未知样品的结果,并可使用OpenSPR-XT完全自动化,为传统ELISA方法提供了极好的替代方法。
实验步骤
1. 将抗-α-乳清蛋白IgG稀释到200µg/ml,加入到PH5.5的醋酸钠中;
2. 在激活后的芯片表面注入α-乳清蛋白,以20ul/min固定5min;
3. 将要分析的α-乳清蛋白分别稀释至3000,2000,1000,750,500,300,200,100,50,10和1ng/ml;
4. 每种浓度结合时间3min,解离时间6min,不同浓度之间用glycine-HCl再生注射;
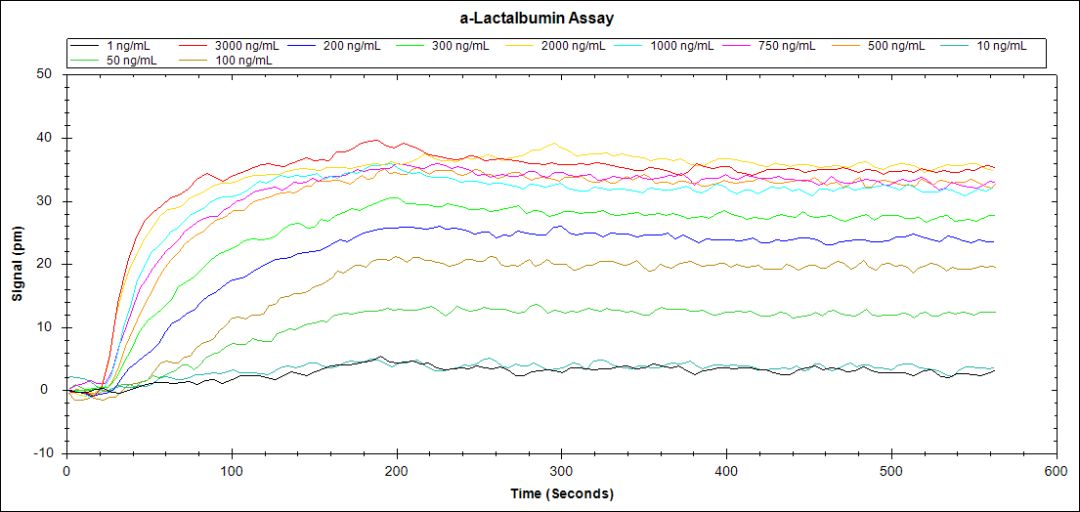
Binding of α-lactalbumin to anti- α-lactalbumin at concentrations of 3000, 2000, 1000, 750, 500, 300, 200, 100, 50, 10, and 1 ng/ml.
数据分析
将α-乳清蛋白IgG固定后,用乙醇胺封闭表面后,用glycine-HCl再生,重复两次注入3000 ng/ml α-乳清蛋白测试条件后,再将 11种不同浓度的α-乳清蛋白分别注入,每次注入之间通过HCL 再生。实验完成后,将数据导入TraceDrawer™并使用affinity/EC50模块进行分析,以确定反应方程:
Y = Rmax*c/(c+KD) + offset
Y 为SPR 反应, Rmax 为饱和信号值, c 为分析物浓度 ,KD为亲和力常数。使用非线性回归。下面的等式确定了检测情况: KD: 8.47nM;Rmax: 37.2;pm Offset: 3.65 pm ;Y= 37.2*c/(c+8.47nM) + 3.65
软件拟合的所有常数获得极低的误差以及低的1.55卡方值。输入样品的SPR信号为“Y”并求解浓度即可确定未知浓度的α-乳清蛋白浓度 。本次实验测定的动态范围是15ng/ml-1000ng/ml,仪器的理论检测限为3ng/ml。这些参数可通过优化可进一步改进或提高,以适应不同的检测需要。相同浓度重复的CV值约为6% ,比较良好。该测定方法的性能足以满足工业应用,并且与Biacore结果媲美。
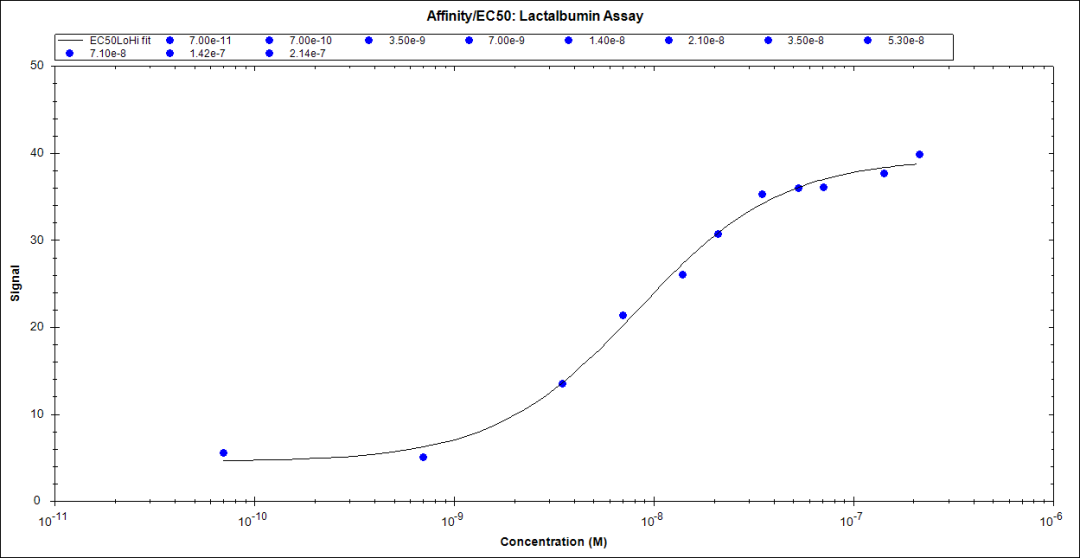
Affinity analysis of α-lactalbumin binding assay
OpenSPR测定蛋白浓度优势
表面等离子体共振(SPR)是可以用于确定生物分子活性浓度的一种非常精确的方法,其基于与特异性结合配体的高亲和力相互作用测定,从而可以进行速率的检测和终点测定。目前,研究人员用了很多不同的方法测定蛋白浓度,包括UV光谱,Bradford,Lowry方法和BCA(Bicinchoninic Acid)。每种方法都有不同的优点和缺点。
比如The Lowry, BCA and Bradford测定法是测量溶液中蛋白的总浓度。相比之下,ELISA和SPR可以测量溶液中特定蛋白的浓度,因此研究人员可测定测量复杂的溶液中特定蛋白的浓度。然而,由于ELISA是终点分析,因此在分析中涉及到的步骤较多,与SPR相比,其很难定位出现错误的环节。此外,由于消耗大量的抗体和需要标记,以及需要多次洗涤和孵育步骤,ELISA更耗时且成本更昂贵,因此这些方法都不是蛋白浓度测定方法的最佳选择。
OpenSPR采用的基于纳米金颗粒的创新LSPR检测技术,在蛋白浓度的测定应用中是一种操作简单、快速且经济有效的浓度分析方法,此外SPR还可以用于许多其他目的研究。它是一种无标记技术,可以让研究人员实时定量分析两种生物分子间的结合动力学。SPR技术可以帮您确定相互作用的 kon, koff 和KD值,与只提供终点测量的其他技术相比,可以更深入的了解分子间的结合作用情况。
Nano Letters杂志快报---OpenSPR分子互作助力口服型肺炎纳米靶向药物研究
技术快报---OpenSPR 磷脂动力学分析数据助力心脏健康研究!
技术快报---OpenSPR助力JAK/Stat信号通路抗癌药物分子机制研究
技术快报----OpenSPR检测数据助力推进生物治疗药物的新发现
Nicoya OpenSPR Co-IP 实时检测新进展:NRF2/PIK信号通路研究
Nicoya OpenSPR在GST标签蛋白检测中的独特优势
看科研大咖们如何大赞Nicoya OpenSPR分子互作技术
Nicoya OpenSPR 在酶类研究中的创新应用------ β羧化β-碳酸酐酶结构对γ-碳酸酐酶结合的影响
Nicoya OpenSPR个人型分子互作仪----助您科研登峰造极的好工具!

