
- 所有服务
- 生命科学服务平台
- 诊断原料开发服务平台
- 抗体药物研发服务平台
西南大学ACSNANO---OpenSPR揭示纳米药物如何不被巨噬细胞吞噬

克服网状内皮系统(RES)的阻碍一直是纳米颗粒作为药物载体的一个重要挑战。聚乙二醇(PEG)修饰的纳米粒有助于避免巨噬细胞的清除,但也抑制了靶细胞对纳米粒的内化。而与PEG修饰不同,RES封闭策略是一种抑制/清除巨噬细胞以提高纳米粒体内递送效率的策略。常规的RES封闭策略是通过预先注射有机或无机材料来抑制/杀死巨噬细胞,但是这些材料往往具有系统毒性。因此,采用空白脂质体(CL)封闭RES是安全且更适合临床的治疗方式, 然而,CL在RES中清除速度较快,因此每次治疗都需要重复注射CL以再次封闭RES,所以具有剂量大和时效性差的缺陷。
以此为切入点,基于CD47蛋白与巨噬细胞表面受体SIRPα蛋白互作后激发“don’t-eat-me”信号通路能够抑制巨噬细胞的吞噬作用,西南大学药学院特聘教授李翀课题组设计了一种新型RES封闭策略(“Don’t-eat-us”策略)以长时间特异性地抑制巨噬细胞摄取能力。在该研究中,李教授带领唐宜轩博士等人设计了一种CD47衍生的、耐酶解的D型Self肽(D-Self, DS),并将其修饰在空白脂质体表面(DSL)。DSL进入体内后会快速与巨噬细胞作用,而DS与SIRPα的互作使DSL能够长期抑制巨噬细胞的吞噬能力,使后续注射的制剂可以有效规避被巨噬细胞快速清除。该结果于2019年11月发表在ASCNANO期刊上(IF 13.7),《Overcoming the Reticuloendothelial System Barrier to Drug Delivery with a “Don’t-Eat-Us” Strategy》
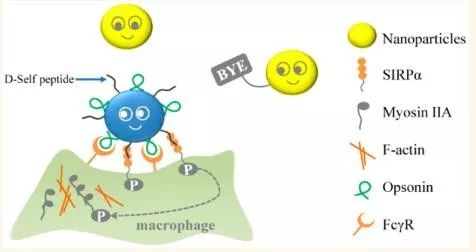
实验介绍
采用同源模建和分子对接得到小鼠CD47蛋白的活性功能序列—天然“Self”肽(Natural Self peptide, NS),采用逆反异构化设计得到耐酶解的D型Self肽(DS)。多肽经固相合成后,通过Nicoya OpenSPR分子互作仪测定多肽与小鼠SIRPα蛋白的动力学参数,结果显示DS与小鼠SIRPα的结合常数为0.64μM(kD)(图1b),类似于天然L型肽(kD=0.57μM)(图2),证明构建的D型多肽(DS)能完整模拟L型多肽(NS)的生物活性。
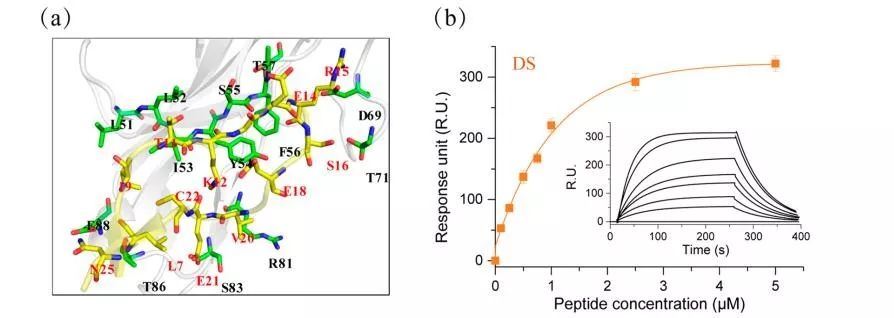
图1.DS与小鼠SIRPα动力学检测
体外实验:基于上述OpenSPR筛选出的高活性DS,将其标记在脂质体上(DSL),并用于细胞摄取实验,结果显示DSL与巨噬细胞作用后,在体外可在细胞上维持超过24小时。
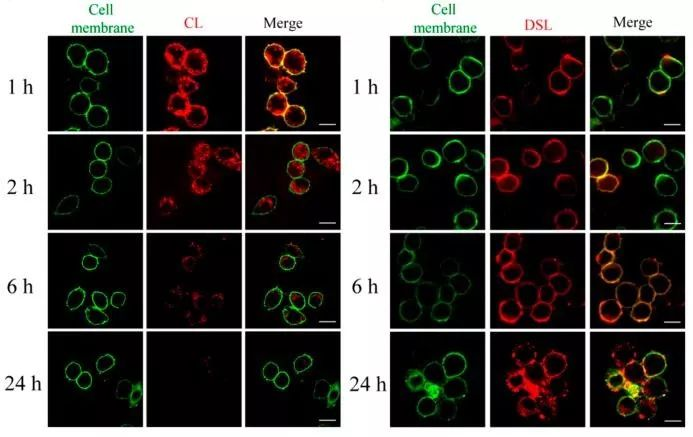
图3. CL与DSL 处理的细胞成像
体内实验
将DSL注入小鼠体内后,结果显示DSL从肝脏和脾脏的延迟清除超过48小时(图4a,b)。在DSL预处理后继续尾静脉给与PLGA纳米粒(PLGA NP),结果显示PLGA NP的体内循环时间被显著延长,且在肝脏和脾脏的分布明显减少(图4c,d)。
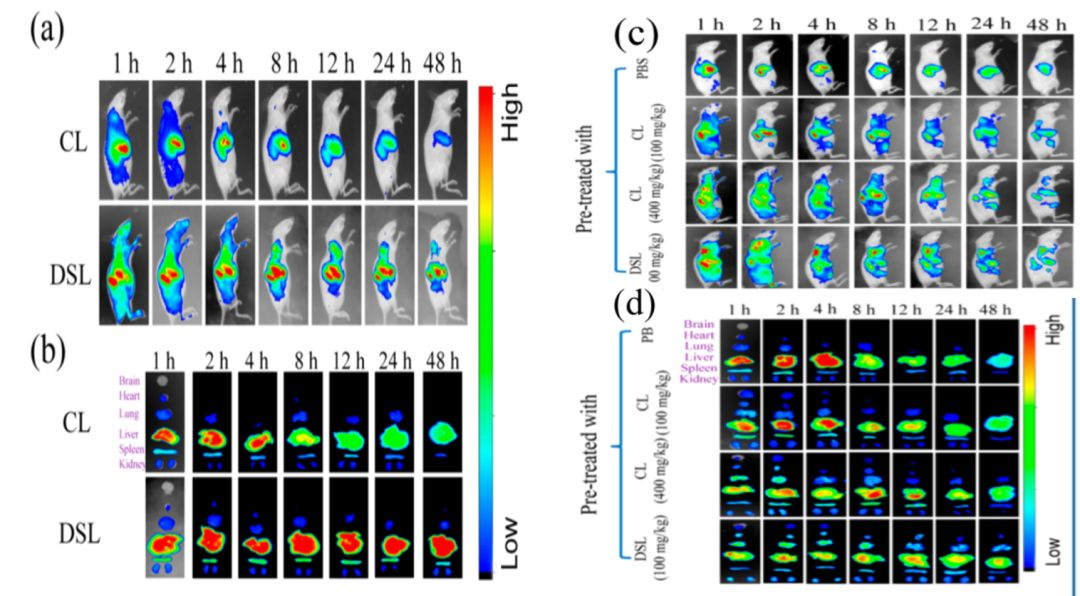
疾病模型验证,用脑靶向配体蜂毒明肽(APA)修饰PLGA NP(APA-PLGA NP),注入体内,成像显示通过DSL封闭RES后增强了APA-PLGA NP脑靶向递送的能力,而大剂量CL封闭RES后,也会对内皮细胞的摄取产生一定的抑制作用,阻碍了APA-PLGA NP的靶向递送。

图5.APA-PLGANP穿越BBB的观察。给药后2小时用LSFM观察小鼠大脑中APA-PLGA-NP(绿色)的三维荧光图像,DLS处理的APA-PLGA NP穿越BBB的效果显著增强。
总结
这些结果表明通过Nicoya OpenSPR筛选得到的高亲和力的DS,并用其标记脂质体(DSL),这些DSL无论在细胞学实验还是疾病模型的实验中都表现出良好的延时清除现象,而在DSL预处理后给与纳米粒,可以在维持纳米粒与靶细胞的显著亲和力的情况下显著延长纳米粒的循环时间,从而明显提升纳米粒的靶向递送和在体疗效。该策略为长循环递药研究提供了新的思路,并且因为无需对递药系统进行额外化学修饰,该策略可与各类递药系统联用,具有广泛的应用前景。
更多详情请阅读原文《Overcoming the Reticuloendothelial System Barrier to Drug Delivery with a “Don’t-Eat-Us” Strategy》
