
- 所有服务
- 生命科学服务平台
- 诊断原料开发服务平台
- 抗体药物研发服务平台
Parkin通过两步机制激活NLRP3炎性小体以驱动帕金森病中的神经变性
中脑黑质致密部(SNpc)中多巴胺能(DA)神经元的死亡是帕金森病(PD)的标志,α-突触核蛋白(α-syn)的神经元内积累和线粒体功能障碍是PD的主要病理学特征。NLRP3 炎性小体是先天免疫系统的主要组成部分,是由胞质模式识别受体 NLRP3、衔接蛋白ASC和caspase-1(Casp1)组成的三蛋白复合物,其组装通常由病原体感染和无菌炎症原触发。尽管小胶质细胞中NLRP3炎症小体的过度活化已在包括PD在内的各种神经退行性疾病中得到充分证明【1, 2】,但具体机制还不得而知。
2022年6月1日,来自美国约翰霍普金斯大学医学院的Ted M. Dawson团队和Valina L. Dawson团队在Neuron杂志上合作发表了一篇题为Neuronal NLRP3 is a parkin substrate that drives neurodegeneration in Parkinson’s disease的文章,他们证明DA神经元中Parkin活性丧失导致NLRP3炎性小体组装和激活的具体机制,因而限制神经元中NLRP3炎性小体激活的策略将有望作为缓解PD疾病的潜在疗法。
研究人员在定向敲除中脑SNpc DA神经元中的Parkin后,观察到NLRP3和切割型Casp1蛋白水平增加,以及ASC寡聚化形成,但这些蛋白的mRNA水平并未改变,说明Parkin的缺失在蛋白质水平上促进NLRP3炎性小体的激活。已有研究指出NLRP3炎性小体进化出两步机制以防止其意外组装激活,一为启动信号NLRP3蛋白,二为激活信号,由mitoROS的产生引发,导致ASC 寡聚化和蛋白酶 Casp1 的自身蛋白水解激活【3】。结合上述发现,研究人员首先证实parkin蛋白可以与NLRP3发生直接结合作用,并能引起NLRP3的多泛素化修饰,在蛋白半衰期测定实验中,Parkin蛋白的缺陷可以明显增加NLRP3的稳定性。

已知parkin相互作用底物(parkin-interacting substrate, PARIS)ZNF746可以诱导线粒体生物发生抑制,且线粒体功能障碍介导的mitoROS产生对于NLRP3炎性小体激活是必要和充分条件【4, 5】。基于此,他们在Parkin缺陷小鼠中通过shRNA定向沉默PARIS的表达,此时,切割型Casp1和ASC寡聚化显著降低,但NLPR3并无明显改变,一方面说明炎性小体的启动和激活是相互独立的过程,另一方面也说明NLRP3炎性小体的激活需要PARIS。随后,他们在Parkin缺陷小鼠中通过shRNA定向沉默NLRP3的表达,这一处理可以有效阻止DA神经元的丢失。类似的,如果将激活途径上的蛋白酶Casp1沉默也能表现出显著的DA神经元保护作用。
α-syn原纤维(pre-formed fibril, PFF)注射到小鼠纹状体中可以导致Parkin失活,及其底物累积和线粒体缺陷【6】。通过构建α-syn PFF模型,研究人员发现Parkin活性降低伴随着NLRP3的启动和激活。为了评估神经元炎性小体的激活是否有助于病理性α-syn PFF触发的DA神经元的神经变性,他们将α-syn PFF注射至Casp1+/+和Casp1-/-小鼠纹状体中,后者的DA神经元丢失表型得以挽救,显著改善酪氨酸羟化酶的表达并降低了寡聚α-syn的累积。与这些发现一致的是,人类PD患者死后也表现出SNpc裂解物中的NLRP3、PARIS和切割型Casp1水平显着上调。

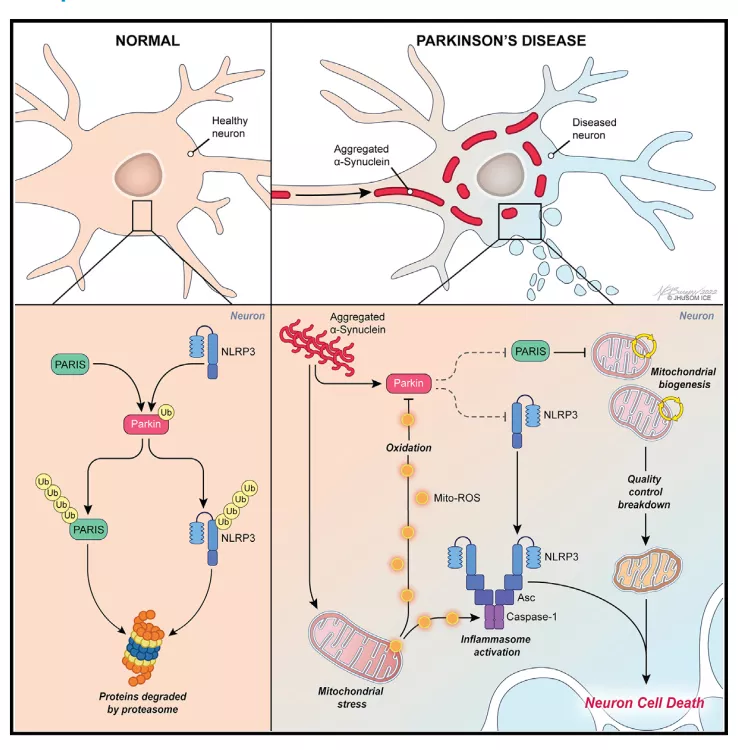
总的来说,这项工作强调了E3泛素连接酶Parkin在抑制DA神经元内NLRP3炎性小体的启动和激活过程中发挥重要作用,一方面Parkin结合并多聚泛素化NLRP3,将其作为蛋白酶体清除的目标,另一方面Parkin底物PARIS的积累能够引起mitoROS产生从而促进NLRP3炎性小体的激活。因此,靶向炎性小体激活可能作为包括PD在内的神经退行性疾病的潜在治疗策略。
