
- 所有服务
- 生命科学服务平台
- 诊断原料开发服务平台
- 抗体药物研发服务平台
雷公藤红素通过诱导活化肝星状细胞(HSCs)的铁死亡来改善肝纤维化的作用及其分子机制
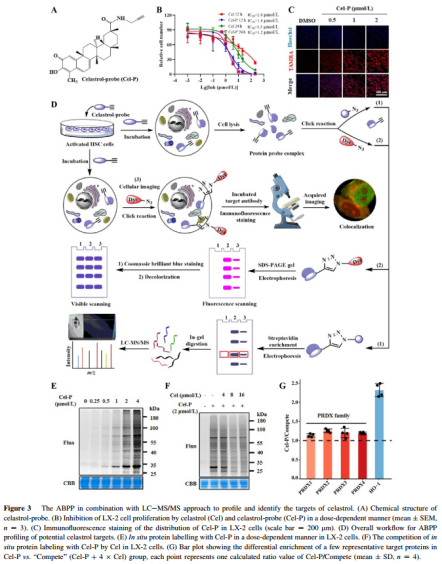
肝纤维化是全球导致死亡和疾病的主要原因之一,但遗憾的是目前仍缺乏有效的治疗药物。尽管肝纤维化的分子机制较为复杂,但其本质是一个动态过程,主要特征为细胞外基质(ECM)沉积,主要由肝病毒感染、代谢紊乱、酒精性肝病和胆汁淤积引起肝星状细胞(HSCs)的激活会促进ECM、促炎性细胞因子和蛋白酶的分泌,进而引发细胞损伤和纤维化。激活的HSCs现已被确认为人类纤维化性肝病及实验性损伤的关键驱动因素,参与多个阶段,包括急性及慢性肝炎以及肝硬化。因此,清除激活的HSCs被视为治疗肝纤维化的有前景的治疗策略。先前研究表明,诱导激活的HSCs发生凋亡、坏死或衰老可缓解肝纤维化的病理进展。 铁死亡(Ferroptosis)是一种受调控的细胞死亡程序,由铁依赖性方式下膜脂质过氧化(LPO)的异常积累引起。谷胱甘肽(GSH)耗竭、半胱氨酸/谷氨酸抗转运系统XCE或谷胱甘肽过氧化物酶4(GPX4)抑制等因素均可触发铁死亡。另一方面,铁螯合剂(如去铁胺)和亲脂性抗氧化剂(如N-乙酰-L-半胱氨酸、铁螯合素-1和维生素E)可抑制铁死亡。值得注意的是,铁死亡与多种肝脏疾病的发生和发展密切相关,如脂肪性肝炎、纤维化和肝细胞癌(HCC)。诱导激活的肝星状细胞(HSCs)发生铁死亡正逐渐成为治疗肝纤维化的一种新型且有前景的治疗方法。 雷公藤红素(Celastrol)是一种从雷公藤中提取的具有生物活性的五环三萜化合物,在多种肝脏疾病中显示出有效的抗纤维化和抗炎活性。然而,雷公藤红素治疗肝纤维化的确切分子作用机制和直接蛋白靶点在很大程度上仍不清楚。 2021年12月,南方科技大学发表论文《Celastrol induces ferroptosis in activated HSCs to ameliorate hepatic fibrosis via targeting peroxiredoxins and HO-1》,作者通过动物实验、pull-down、ABPP、CETSA-WB等实验证明了雷公藤红素通过促进ROS的产生和诱导活化HSC细胞的铁死亡来有效改善肝纤维化,并揭示了雷公藤红素触发铁死亡的作用机制和细胞靶蛋白。 为了鉴定雷公藤红素对应的潜在靶蛋白,作者设计出了带有可点击的炔烃标签的雷公藤红素探针(Cel-P)。首先评估探针在人LX-2细胞和小鼠肝星状细胞(mHSC)中的抗纤维化活性,经实验发现炔烃标签不会影响雷公藤红素的活性,并且经点击化学反应,发现亚细胞定位主要分布在细胞质和细胞核。 对LX-2和mHSC细胞进行Cel-P的原位标记,许多蛋白质以剂量依赖性方式被Cel-P标记,此外与过量雷公藤红素进行共孵育的话,可以竞争性抑制Cel-P在细胞中的原位标记。 ABPP策略鉴定与Cel-P结合的蛋白质。将Cel-P与LX-2细胞共孵育过的细胞蛋白提取物与biotin-N3共孵育,经链霉亲和素磁珠亲和纯化跑胶,进行LC-MS/MS鉴定。结果发现,Cel-P组中血红素加氧酶1 (HO-1)显著更高,而且发现Cel-P组中peroxiredoxin (PRDX)家族蛋白的相对富集,PRDX蛋白是一个重要的非硒过氧化物酶家族,有六个成员,其中,PRDX6为铁死亡的调控因子。 通过pull-down验证雷公藤红素与PRDX家族成员之间的直接相互作用。Cel-P成功下拉PRDX1、PRDX2、PRDX4和PRDX6,但未能下拉PRDX3和PRDX5,此外,雷公藤红素可竞争性地阻断Cel-P与上述四种PRDX蛋白的结合,Cel-P也能特异性下拉HO-1。在细胞裂解液CETSA-WB实验中,PRDX1、PRDX2、PRDX4、PRDX6和HO-1均显示出显著的热稳定性,同样验证了与Celastrol的直接相互作用。
研锦生物可以利用基于靶点或小分子结构的药物设计方法,对可购买化合物、天然产物等数据库进行虚拟筛选,并获得潜在活性的化合物列表供进一步活性实验确证。面向制药企业和科研院所,可提供一站式的早期药物研发服务,包括虚拟药物筛选、先导优化、靶标预测、 动力学模拟等,涉及小分子化学药、生物药、中药等多种新药类型,为您提供优质的药物发现服务
