
- 所有服务
- 生命科学服务平台
- 诊断原料开发服务平台
- 抗体药物研发服务平台
LiP-MS靶点垂钓技术:原理、挑战与精准化策略
靶点识别是新药研发的核心瓶颈,尤其对于天然产物这类难以修饰的小分子而言。有限蛋白酶解-质谱联用技术(LiP-MS)凭借无需探针标记、可捕获天然状态蛋白构象变化的独特优势,成为药物靶点发现领域的新锐工具。然而,其在复杂体系中的应用仍面临假阳性干扰、低丰度蛋白漏检等现实挑战。本文结合最新研究进展,系统解析LiP-MS的技术原理、优化策略与前沿应用,为实现精准"钓靶"提供方法论参考。
一、技术原理:从构象变化到靶点解码
LiP-MS的核心机制在于利用小分子与靶蛋白结合引发的空间构象改变,影响蛋白酶对特定切割位点的可及性。其技术流程主要分为三步:
1. 非变性孵育:
在生理条件下将小分子与细胞裂解液或组织蛋白共孵育,维持蛋白质的天然构象;
2. 两步酶解:
有限酶切:加入广谱蛋白酶(如蛋白酶K)进行短暂水解,小分子结合区域因构象稳定或位阻效应受到保护,切割作用减弱;
深度酶切:变性后用胰蛋白酶彻底消化,生成适合质谱分析的肽段;
3. 差异肽段分析:
通过质谱定量比较处理组与对照组的肽段丰度差异,受保护肽段(丰度升高)与邻近新暴露肽段(丰度降低) 的组合可映射出小分子结合位点。
典型案例:在紫堇灵(Corynoline)抗胰腺纤维化研究中,LiP-MS检测到蛋白酶体亚基PSMA2的一个长肽段(含潜在PK酶切位点)丰度显著升高,而相邻短肽段丰度降低,提示紫堇灵可能结合于二者交界区域。后续DARTS实验进一步验证了这一结合的特异性。
二、应用挑战与假阳性陷阱
尽管原理清晰,LiP-MS在实际应用中仍面临多重技术瓶颈:
低丰度蛋白检出率低:高丰度蛋白的信号易掩盖调控蛋白(如激酶、转录因子),导致关键靶点遗漏;
半酶切肽段干扰:第一步PK酶切的肽段(反映构象变化)与第二步胰酶肽段共存,难以精准区分关键信号;
序列覆盖率不足:若结合位点位于未被质谱覆盖的肽段区域(尤其大分子量蛋白),则无法被识别;
假阳性率高:单剂量实验中,非特异性结合与背景噪声难以区分,导致靶点验证失败率较高。
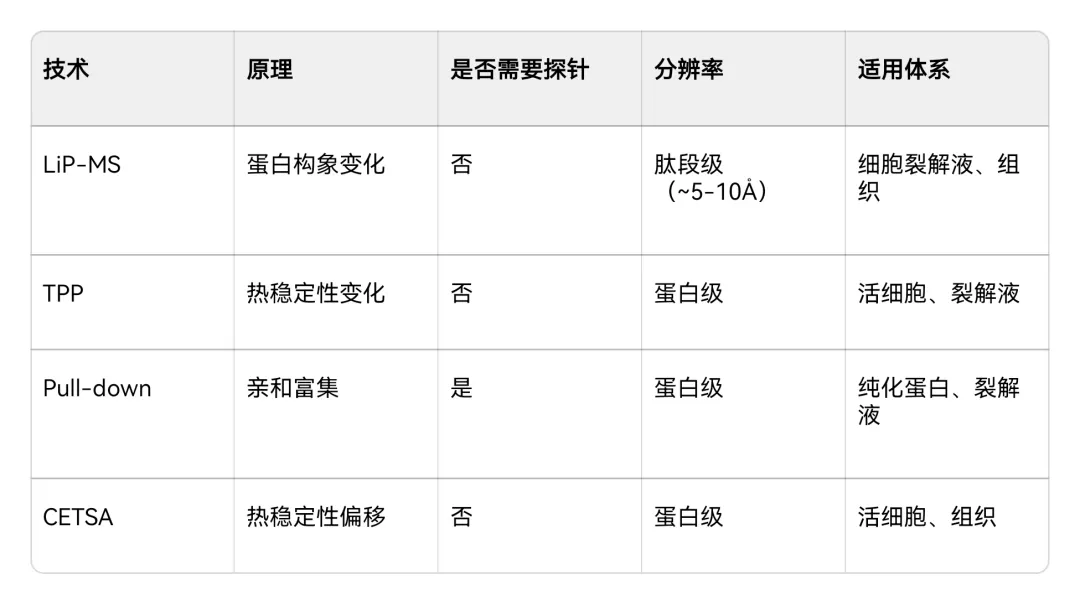
表:LiP-MS与主流靶点鉴定技术比较
三、精准靶点筛选策略:从"大海捞针"到"有的放矢"
为解决上述问题,研究者开发了多维度数据整合策略,显著提升了靶点鉴定效率:
1. 特征肽段驱动法
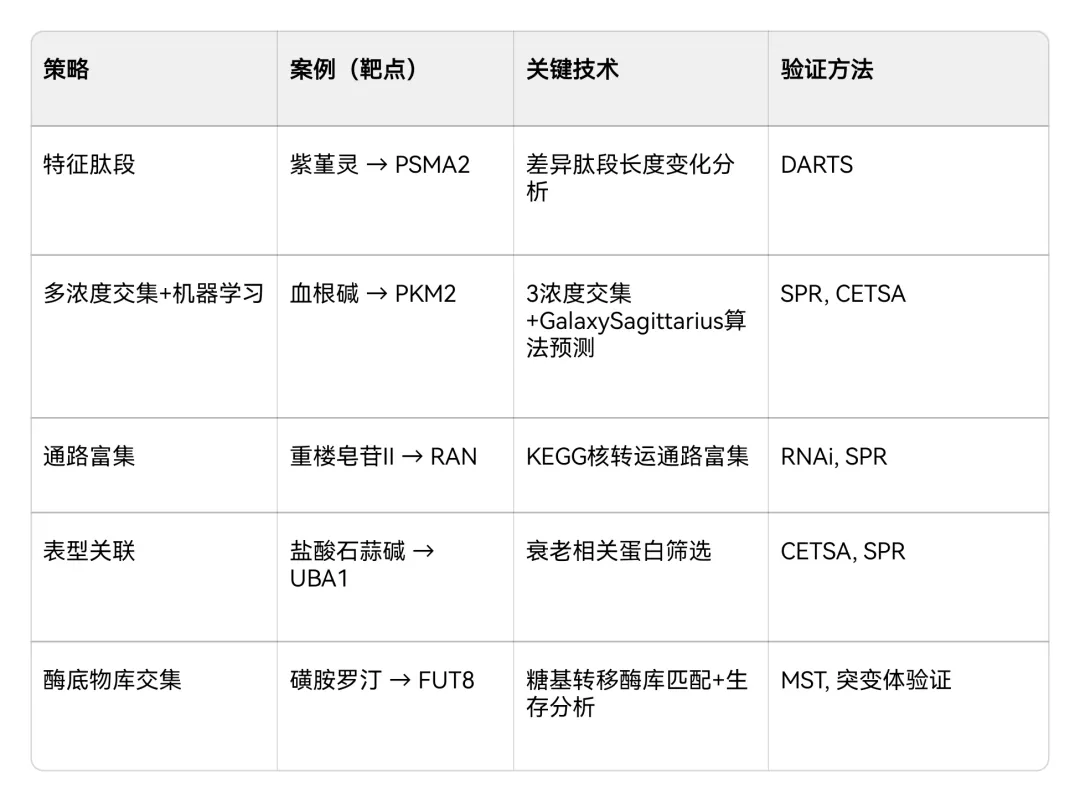
通过识别"长肽段增加+短肽段减少"的特征组合锁定靶点,例如紫堇灵研究中对PSMA2的鉴定。
2. 多浓度交集-机器学习联用
多剂量筛选:采用≥3个药物浓度处理,取共有差异蛋白以降低假阳性(如血根碱研究中通过3浓度交集获得6个候选靶点);
算法辅助:联合GalaxySagittarius等预测工具进行交叉验证(血根碱案例中,多浓度交集与预测结果仅PKM2重叠)。
3. 生物学功能关联
通路富集:重楼皂苷II的LiP-MS差异蛋白富集于核转运通路,据此锁定RAN靶点;
表型关联:盐酸石蒜碱的16个候选靶点中,UBA1因参与衰老通路被优先验证;
酶底物库筛选:磺胺罗汀研究中,通过差异蛋白与糖基转移酶库取交集发现FUT8。
表:经典LiP-MS靶点筛选策略与验证方法
四、技术优化与融合应用
1. LiP-Quant:机器学习赋能精准定量
升级版LiP-Quant通过7个以上药物浓度梯度孵育,结合机器学习模型(如随机森林、支持向量机)分析肽段丰度-剂量响应曲线,显著提升了特异性。实验表明,其假阳性率较传统LiP-MS降低40%。
2. 多技术联建"证据链"
单一技术的证据往往不足,需联合正交验证:
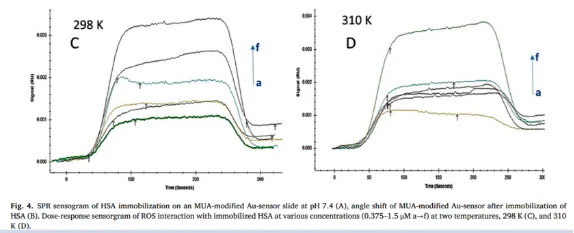
结合力验证:通过SPR测定结合常数(如石蒜碱-UBA1的KD=0.8 μM);
细胞热稳定性:利用CETSA检测靶蛋白熔解温度偏移(如贯叶金丝桃素-Dlat复合物ΔTm=3.2℃);
功能回复实验:通过敲低/过表达靶点观察表型逆转。
3. 样本处理与算法革新
4D-DIA质谱:提高低丰度肽段检出率,使序列覆盖率提升30%;
深度学习模型:如AlphaFold2预测结合口袋,辅助肽段定位。
五、未来方向:从技术突破到临床转化
1. 覆盖度提升:
发展交联质谱(XL-MS) 辅助定位结合界面,弥补酶切盲区;
2. 体内靶点垂钓:
直接分析动物给药后组织样本,同步获取靶点occupancy与转录组/蛋白组响应(如灯盏乙素脑组织靶向PDK2研究);
3. 天然产物开发:
无需纯化探针的特性使其特别适合中药单体(如黄酮、生物碱)靶点发掘,助力中医药现代化;
4. 临床诊断应用:
利用LiP-MS检测疾病相关构象变化蛋白,作为帕金森病、癌症的早期生物标志物。
案例启示:肌苷(中药冬虫夏草成分)通过LiP-MS被发现靶向泛素活化酶UBA6,并证实其可增强肿瘤免疫原性。该研究为天然产物改造免疫检查点抑制剂提供了新路径。
LiP-MS凭借无需探针、可解析结合位点的优势,已成为药物靶点发现的核心工具。通过多浓度设计、机器学习整合及多维验证,可显著提升其在复杂体系中的可靠性。随着高灵敏度质谱与人工智能算法的深度融合,LiP-MS有望在靶向蛋白降解剂开发、天然药物现代化及精准医疗领域实现更突破性的应用。研究者需根据样本复杂度与小分子特性灵活设计策略,方能在"数据迷雾"中锁定真正的靶点灯塔。
研锦生物可以利用基于靶点或小分子结构的药物设计方法,对可购买化合物、天然产物等数据库进行虚拟筛选,并获得潜在活性的化合物列表供进一步活性实验确证。面向制药企业和科研院所,可提供一站式的早期药物研发服务,包括虚拟药物筛选、先导优化、靶标预测、 动力学模拟等,涉及小分子化学药、生物药、中药等多种新药类型,为您提供优质的药物发现服务
