
- 所有服务
- 生命科学服务平台
- 诊断原料开发服务平台
- 抗体药物研发服务平台
SPR技术揭示肝素抗脓毒症新机制——分子互作研究的关键突破
2021年3月9日,国际顶级免疫学期刊《Immunity》发表了中南大学第三湘雅医院重症医学科吕奔教授团队的重要研究成果《Heparin prevents caspase-11-dependent septic lethality independent of anticoagulant properties》。该研究首次阐明肝素通过阻断HMGB1-LPS相互作用和抑制糖萼降解双重机制,抑制caspase-11信号通路,为脓毒症治疗提供了全新视角。其中,表面等离子共振(SPR)技术在解析关键分子互作机制中发挥了决定性作用。 一、研究背景与意义 在脓毒症中,肝细胞释放的HMGB1蛋白作为分子伴侣能将血循环中的内毒素(LPS)转运至细胞浆中,从而活化了LPS的细胞浆受体—Caspase-11并造成脏器衰竭和死亡。研究团队通过大样本临床数据分析发现:接受低分子肝素治疗的脓毒症患者血清IL-1α/β水平显著降低,但传统凝血指标(APTT/TT)未发生明显改变。这一矛盾现象提示肝素可能存在独立于抗凝功能的新型作用靶点。团队进一步构建肝素非抗凝衍生物(NAH)模型,发现其在小鼠脓毒症模型中展现出与普通肝素相当的生存率改善效果(p<0.01),为机制探索指明方向。 二、SPR实验设计:解密分子互作的关键钥匙 研究团队通过系列SPR实验揭示了肝素作用的核心机制: 肝素与HMGB1的高亲和力验证 通过SPR检测发现,肝素及其非抗凝衍生物(NAH)均可与HMGB1蛋白特异性结合,平衡解离常数(KD)达5.59×10⁻⁴,证明肝素家族分子具有直接调控HMGB1功能的能力。 特异性互作模式解析 对比实验显示:普通肝素可同时结合抗凝血酶III(KD=1.56 μM)和HMGB1,而NAH仅保留HMGB1结合能力。这完美解释了NAH为何能在不引起抗凝副作用的情况下维持治疗效果。 竞争性抑制机制可视化 HMGB1-LPS复合物的形成是脓毒症恶化的重要环节。在HMGB1固定化芯片上,SPR实时监测显示:添加肝素后,LPS与HMGB1的结合信号显著降低(响应值下降>80%),首次从动力学角度证实肝素通过空间竞争阻断HMGB1-LPS复合物形成。 三、SPR技术优势:从现象到机制的全链条解析 本研究成功展示了SPR技术在复杂生物学问题研究中的独特价值: 精准定量 通过多浓度梯度实验和稳态分析,精确测定肝素/HMGB1互作亲和力,为后续结构优化提供数据支撑。 动态监测 实时追踪三元复合物(HMGB1-LPS-肝素)形成过程,解析竞争抑制的时间依赖性特征。数据显示肝素在结合后30秒内即可占据80%的HMGB1结合位点。 特异性区分 通过平行实验明确不同肝素衍生物的靶向结合特性,指导NAH分子设计。团队据此开发出硫酸化程度降低12%但HMGB1结合保留率达95%的新型衍生物。
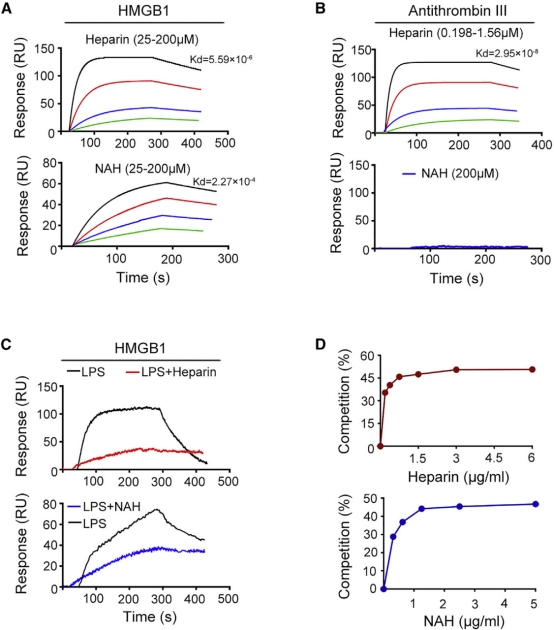
Tang Y, Wang X, Li Z, He Z, Yang X, Cheng X, Peng Y, Xue Q, Bai Y, Zhang R, Zhao K, Liang F, Xiao X, Andersson U, Wang H, Billiar TR, Lu B. Heparin prevents caspase-11-dependent septic lethality independent of anticoagulant properties. Immunity. 2021 Mar 9;54(3):454-467.e6. doi: 10.1016/j.immuni.2021.01.007. Epub 2021 Feb 8. PMID: 33561388.
研锦生物可以利用基于靶点或小分子结构的药物设计方法,对可购买化合物、天然产物等数据库进行虚拟筛选,并获得潜在活性的化合物列表供进一步活性实验确证。面向制药企业和科研院所,可提供一站式的早期药物研发服务,包括虚拟药物筛选、先导优化、靶标预测、 动力学模拟等,涉及小分子化学药、生物药、中药等多种新药类型,为您提供优质的药物发现服务
