
- 所有服务
- 生命科学服务平台
- 诊断原料开发服务平台
- 抗体药物研发服务平台
一种可抑制破骨细胞骨吸收的新型Nrf2激动剂
骨质疏松症是一种以骨密度降低、骨微结构破坏、骨折风险增加为特征的代谢性骨病。破骨细胞过度活化是引起骨质疏松的重要原因之一。目前已有多种靶向破骨细胞分化和功能的药物用于临床,如双膦酸盐和地舒单抗,但这些药物往往也存在许多不足之处,如双膦酸盐会引起严重的下颌骨坏死等并发症,而地舒单抗则存在严重的停药反弹效应。寻找新的治疗靶点和开发更安全有效的治疗药物,可以为骨质疏松的规范治疗提供更多的选择。 Nrf2是一种在细胞抗氧化应答中发挥核心作用的转录因子。Nrf2激活后能够启动多种抗氧化和细胞保护基因的表达,降低ROS损伤。因此,探索安全有效的Nrf2小分子激活剂也是各种慢性氧化应激和炎症性疾病药物的重要研发方向。目前,Nrf2激活剂主要分为两种,即亲电性Nrf2激活剂和直接Nrf2激活剂
【1】。亲电性激活剂具有副作用大, 特异性差,存在脱靶效应等不足,因而只能用于罕见病治疗。目前只有两种已被批准用于临床,即治疗复发性多发性硬化症的富马酸二甲酯
【2】 和治疗弗里德里希共济失调症的omaveloxolone
【3】。而直接Nrf2激活剂尚处于实验室研发阶段,没有一款进入临床评估阶段,且直接Nrf2激活剂的分子量常常比较大,难以透过血脑屏障用于中枢神经系统疾病的治疗。

Bitopertin是一个处于临床阶段的甘氨酸摄取抑制剂,原本用于治疗精神分裂症和血液系统疾病,但其作为甘氨酸抑制剂的临床试验效果均不理想。本研究发现,Bitopertin可以与Keap1的Kelch结构域相互作用,减少Keap1与Nrf2的结合而激活Nrf2。Bitopertin可以抑制破骨细胞分化和骨吸收功能,并缓解由雌激素缺失引起的骨质疏松。与其他临床上批准的Nrf2激动剂相比,Bitopertin在人类受试者中引起的不良反应发生率更低,体内安全性更高,有望作为一款新的Nrf2激活剂候选药物使用。 目前Nrf2调控破骨细胞分化的下游直接分子机制尚不明确【4】。该研究进一步整合转录组学和单细胞测序等揭示了Nrf2可以转录激活Slc40a1/Ferroportin的表达来调控破骨细胞内铁代谢,并通过UK Biobank前瞻性临床数据分析和单核苷酸多态性分析等揭示了铁代谢和骨质疏松的关联。进一步联合转录组学和代谢组学发现Nrf2和铁可以通过调控Odc1来影响鸟氨酸代谢,进而影响破骨细胞活性和骨质疏松发生发展。
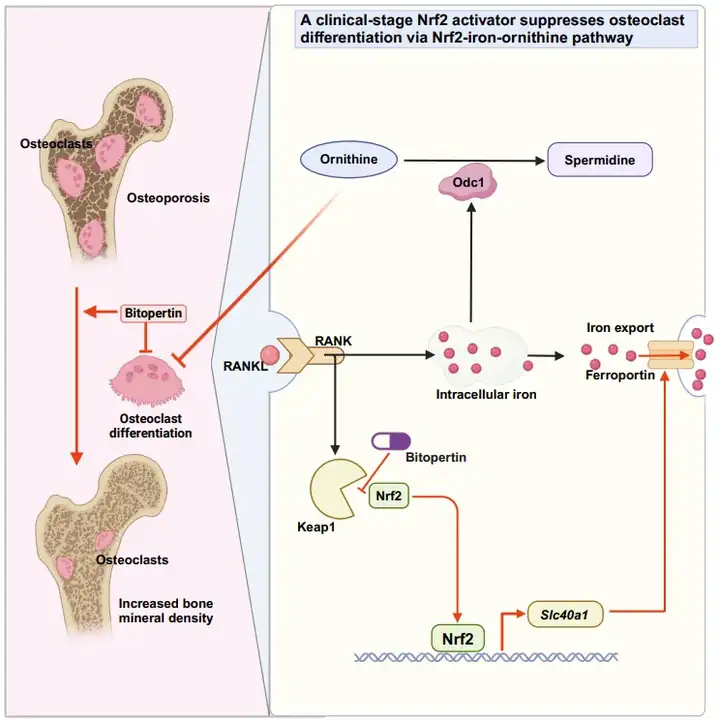
总体而言,这项研究揭示了Bitopertin作为Nrf2激动剂在各种氧化应激和炎症性疾病中的应用潜力,揭示了Nrf2调控破骨细胞分化的深入分子机制,并提出了靶向Nrf2-iron-Odc1轴对骨质疏松的治疗策略。
