
- 所有服务
- 生命科学服务平台
- 诊断原料开发服务平台
- 抗体药物研发服务平台
EGFR的结构及生物学功能介绍
EGFR的结构
EGFR 是一个含有 1186 个氨基酸的跨膜糖基化蛋白,其结构由三个部分组成(图1.1):胞外结构域(N端),穿膜结构域(TM,疏水的 α 螺旋结构)和胞内结构域(JM、TK、C 端)。
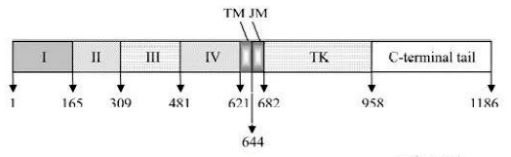
图1.1 EGFR结构示意图
GFR胞外域(N端)共621个氨基酸残基,含有接受外部信号相关的N末端(配体结合区),由Ⅰ、Ⅱ、Ⅲ、Ⅳ四个亚区(或相应称为L1、S1/CR1、L2、S2/CR2亚区)构成(图1.2)。Ⅰ区结合TGFα多数肽链,Ⅱ区通过主要的保守氨基酸残基与配体相互作用[5-6]。Ⅱ和Ⅳ区富含半胱氨酸,共50个半胱氨酸残基,全部参与形成分子内25个二硫键。另外胞外域存在12个潜在的N-糖苷键连接的糖基化位点,其中Ⅰ、Ⅱ区各有2个,Ⅲ、Ⅳ区各有4个。
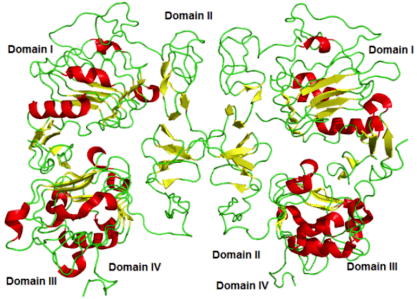
图1.2 EGFR胞外域结构示意图
穿膜结构域(TM)是由23个氨基酸残基构成螺旋状结构的疏水区域,跨膜区锚定在细胞膜上。
胞内结构域(JM、TK、C端)是具有蛋白激酶结构域的细胞质内羧基端区域,共542个氨基酸残基,包含了3个子区域,分别是酪氨酸激酶区(TK),近膜区(JM)和C端末区(CTD)。酪氨酸激酶区有ATP结合位点,在EGFR与配体结合发生二聚化后,ATP与位点结合,激活下游信号通路。近膜区能够调节激酶二聚化,对下游信号通路有调节作用。C端末区在EGFR被激活时,发生自身磷酸化,磷酸化残基募集活化细胞内的信号转导途径。
2 EGFR分子生物学功能
EGFR为具有酪氨酸激酶活性的重要跨膜受体,位于细胞膜表面,靠与配体结合来激活。EGFR 的配体有表皮生长因子EGF、转化生长因子 (Transforming Growth Factor, TGF-α)等。配体(EGF 和 TGF-α)和 EGFR 共同在癌细胞表面过表达,导致了EGFR 通路的异常调节,引起细胞恶性增殖[9]。当EGFR激活后由单体转化为二聚体(图1.3),EGFR二聚后可以激活它位于细胞内的激酶通路 。
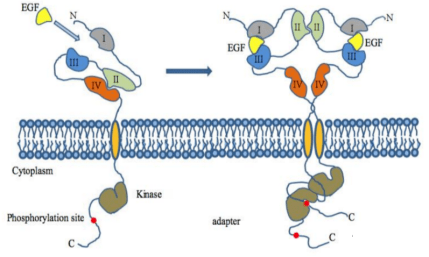
图1.3 EGFR通过EGF配体激活形成二聚体流程示意图
EGFR受体可激活三个信号通路:参与免疫调节的JAK/STAT信号通路,参与细胞增殖的RAS-RAF-MEK途径(MAPK/ERK通路),以及参与细胞存活的PI3K-AKT-mTOR途径(图1.4)。RAS-RAF-MEK途径负责控制基因转录活动和细胞循环周期,而PI3K-AKT-mT0R途径可激活抗细胞凋亡的信号。因此,EGFR受体蛋白在细胞增殖及存活上有着非常重要的作用。三种信号通路是细胞内信号转导的基础,调控肿瘤细胞诸多生理变化如:分裂、分化、生长以及迁移等。
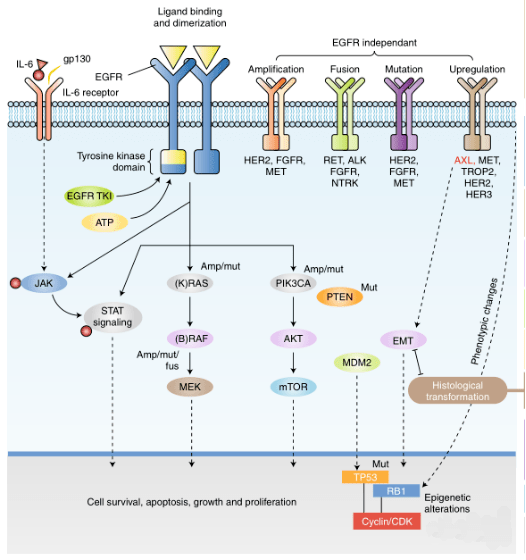
图1.4 EGFR受体蛋白激活JAK-STAR、RAS-RAF-MEK和PI3K-AKT-mTOR信号通路示意图
EGFR信号通路的激活可以分为四个步骤:1受体与配体结合,2受体形成二聚体,3酪氨酸激酶区的活化和C末端酪氨酸残基磷酸化,4下游信号传导RAS/RAF/MEK,PI3K/AKT,STAT等。
EGFR过度表达,会激活下游信号通路,使得细胞生长无法抑制,肿瘤细胞增殖、转移等特性得以增强,最终促使肿瘤病变的发生。
研锦生物可以利用基于靶点或小分子结构的药物设计方法,对可购买化合物、天然产物等数据库进行虚拟筛选,并获得潜在活性的化合物列表供进一步活性实验确证。面向制药企业和科研院所,可提供一站式的早期药物研发服务,包括虚拟药物筛选、先导优化、靶标预测、 动力学模拟等,涉及小分子化学药、生物药、中药等多种新药类型,为您提供优质的药物发现服务
