
- 所有服务
- 生命科学服务平台
- 诊断原料开发服务平台
- 抗体药物研发服务平台
药物亲和反应的靶点稳定性(drug affinity responsive target stability,DARTS)
在生理条件下,蛋白质处于动态平衡状态,具有多种替代构象,还可能表现出一定程度的局部可逆展开。当特定配体(如药物)结合时,由于蛋白质和药物配体之间形成的疏水、氢键或静电相互作用导致自由能变化,平衡将转向高度有利于配体结合的构象,这导致了热力学上更稳定的状态。在这种状态下,目标蛋白的构象变化显著减少,对变性和蛋白酶水解的抵抗力显著增强。
DARTS的基本原理是小分子配体与靶蛋白结合后可以稳定靶蛋白,增强其对蛋白水解酶水解作用的抗性,如图所示。蛋白与小分子药物结合后,对亲和反应后的混合蛋白进行酶水解,酶解产物经凝胶电泳分离后,与空白组比较,与药物结合的蛋白片段增多,如图所示。
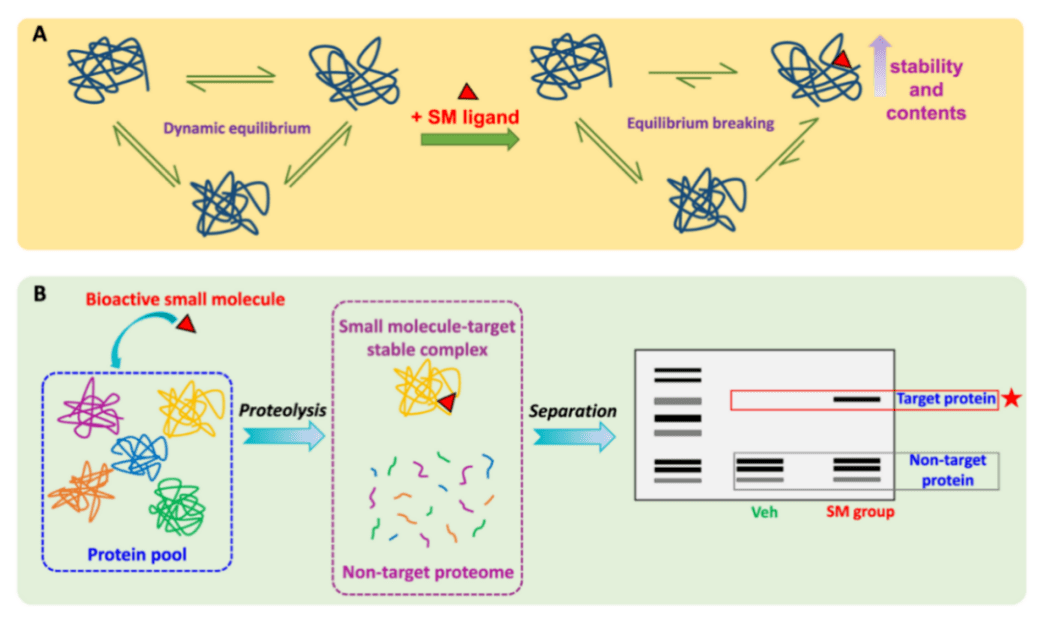
图. DARTS的基本原理
DARTS的基本步骤如下:
(1)蛋白质库的制备;
(2)蛋白质和小分子的孵育;
(3)蛋白酶水解;
(4)通过考马斯亮蓝,银染,免疫印迹等方法检测对照组和加药组蛋白差异;
(5)目标蛋白质凝胶带的收集;
(6)通过质谱等方法对目标蛋白质鉴定;
(7)通过平行实验对靶点进行验证,
DARTS的优势主要有以下三点:
(1)应用于大多数天然的、无需修饰的小分子;
(2)不需要大量的纯蛋白,模式生物的表型特征不受限制,蛋白质样品可以从细胞系或组织的有机体中获得;
(3)可以用于寻找化合物新的靶点,也可以从成分复杂的天然药物和复方药物中发现新的靶点。
如上所述,DARTS技术操作简单,然而仍存在一些局限性,一方面,由于蛋白质库的复杂性,小分子药物与蛋白质之间可能存在一些错误结合;另一方面,在SDS-PAGE和LC-MS分析中,一些低丰度蛋白质的阳性结果容易被忽略;此外,一些错误操作也可能导致假阳性结果,因此,需要通过其他实验方法验证DARTS的实验结果。
研锦生物可以利用基于靶点或小分子结构的药物设计方法,对可购买化合物、天然产物等数据库进行虚拟筛选,并获得潜在活性的化合物列表供进一步活性实验确证。面向制药企业和科研院所,可提供一站式的早期药物研发服务,包括虚拟药物筛选、先导优化、靶标预测、 动力学模拟等,涉及小分子化学药、生物药、中药等多种新药类型,为您提供优质的药物发现服务
