- 所有服务
- 生命科学服务平台
- 诊断原料开发服务平台
- 抗体药物研发服务平台
活细胞成像新技术怎么盘
一背景介绍然而,使用GFP融合标签也存在一定的局限性,包括在各种应用中分辨率受限,GFP因其成熟时间长而臭名昭著,不能观察转录和翻译等短期事件,无法对单分子成像;蛋白质通常在GFP完全成熟时降解。此外,由于GFP成熟时间长,翻译后修饰和构象变化是一个很难解决的问题。因此,用GFP融合标签替代品来解决这种方法固有的局限性是至关重要的。
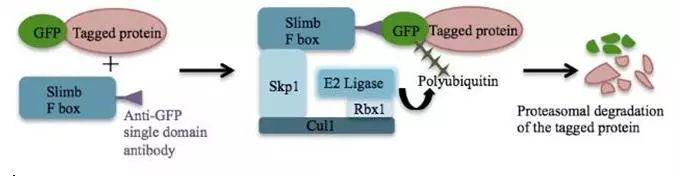
图:蛋白质在GFP成熟后降解示意图二研究简介Dr. Stasevich团队在他们的最近研究中发现了一个可替代GFP标签成像的基因编码探针HA-frankenbody(FB),并将结果发表在 Nature Communications上(PubMed上可免费下载全文),通过OpenSPR获得的结合动力学数据揭示了精心设计的高亲和力探针用于活细胞成像的可行性。

图:Dr.Stasevich团队发表的文章截图在基于抗体的活细胞成像方法中,采用的是抗原结合片段(Fabs) 和单链可变的片段(scFvs)与成熟的荧光团融合。该技术充分弥补了之前描述的GFP的限制(如翻译后修饰/构象改变分辨率,增加追踪时间等),尽管Fabs开发相对简单,但也存在独特的挑战性,如加载到体内系统的能力有限,并且可能会因批次而异。
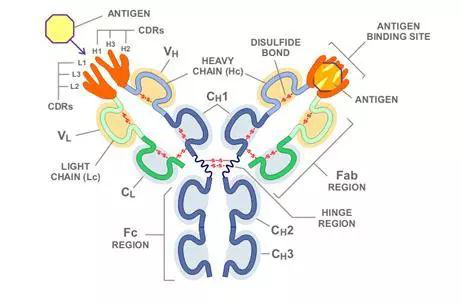
图:Fabs和scFvs与荧光团融合示意图
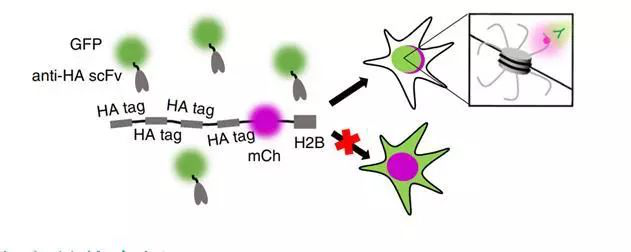
图:筛选活细胞中五个嵌合抗HA scFvS示意图相比之下,基因编码的探针能够很容易的融合进活体系统,大大减少了批次之间的变异性。三研究内容Dr. Stasevich团队研究者精心设计了一种称为“HA-frankenbody”的混合型scFv成像探针FB,是针对HA表位设计。

图:12CA5-scFv CDR使用和稳定的scFv支架设计嵌合抗HA scFv示意通过多种体内技术确认该探针的稳健性、特异性和亲和力,包括蛋白质印迹法、免疫染色法、共定位法和FRAP(荧光漂白后恢复)分析法。 通过实验分析,研究者发现,HA-frankenbody探针对多种细胞类型和在各种条件下都能充分解决带HA标签的细胞质、核、膜和线粒体蛋白、单分子mRNA、斑马鱼胚胎等成像。 重要的是,FRAP分析显示,大多数设计的探针可对活细胞做数分钟的追踪,这表明探针对其表位具有很高的亲和力。
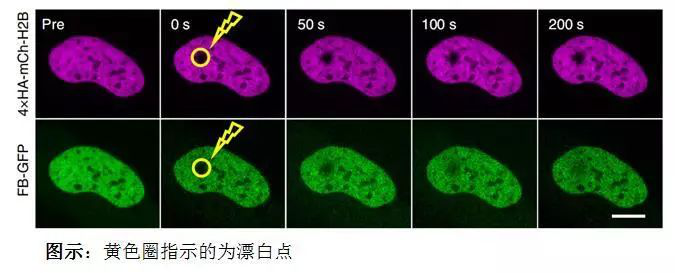
图:FB-GFP(绿色)和靶标4×HA-mCh-H2B(品红色)在细胞中荧光恢复为了进一步证实这些数据结果的有效性和直接性,并量化探针与HA表位间的亲和力,研究者用OpenSPR量化分析了HA-frankenbody 与HA的结合/解离速率 、亲和力,并确认了设计的探针的整体效能,分析获得两者间的KD值为14.7nM,与FRAP分析结果一致,这个数据直接有利的证明了HA-frankenbody 探针可以替代GFP标签,解决带HA标签的活细胞成像问题。
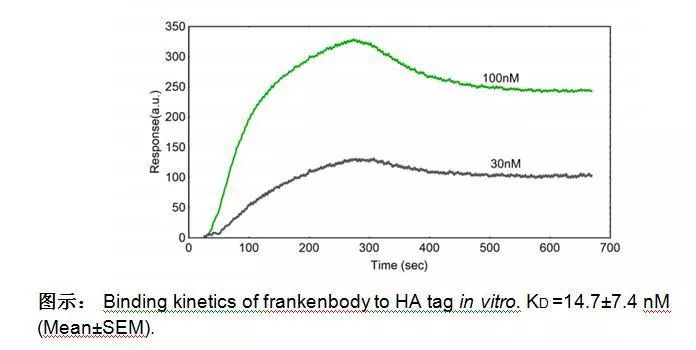
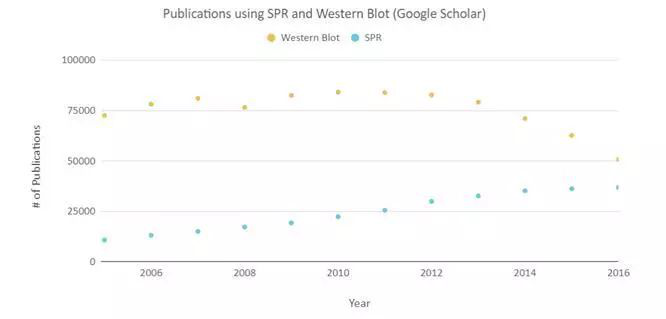
四此研究为什么要用 OpenSPR ?表面等离子共振技术(SPR)可用于直接检测纯化的HA表位标签与HA frankenbody结合常数,生物素化的HA肽段被固定在生物素的芯片上,HA frankenbody用运行缓冲液PBS稀释,注入两个浓度(100nM和30nM)的HA frankenbody,每次运行5min,TraceDrawer 1:1结合模式计算动力学参数,值得注意的是,用openspr测量的KD值为14.7nm与FRAP分析结果一致。 研究人员认为,高亲和力成像探针可提高成像分辨率,因此,OpenSPR结合数据使研究人员能够确认他们的HA-Frankenbody探针作为一种新的成像工具的总体效果。 通过使用OpenSPR,研究人员可以在他们自己的工作台上获取SPR数据,加速了他们的研究并能更快发布他们的研究发现。五SPR数据重要性表面等离子体共振是一种无标记技术,研究人员可以定量分析两个生物分子之间的结合。SPR技术使我们能够确定相互作用的kon、koff和kd,与其他仅提供终点测量的技术(如pull-down)相比,它能更深入地洞察分子间的结合。 SPR不仅对发表文章是必要的,而且对于医学和医学研究的许多领域的进步也是必要的,如下图所示,依赖SPR数据的论文数量显著增加。